
- DOI: 10.1002 / chemv.201500053
- Autor: Klaus Roth
- Data de publicação: 07 de julho de 2015
- Fonte / Editora: Chemie in unserer Zeit / Wiley-VCH
- Copyright: Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim
Tradução autorizada do texto ‘Strychnine: From Isolation to Total Synthesis – Part 3‘
O que obriga os químicos orgânicos a tentar, repetidamente, sintetizar a estricnina de uma nova maneira? Especialmente porque o composto pode ser facilmente isolado diretamente em quantidades de cem gramas, a partir de sementes da nogueira venenosa. O fascínio deve ser particularmente grande, uma vez que quase 20 sínteses totais foram publicadas até agora [45, 46], todas elas únicas (Tabela 2).A motivação pessoal associada a uma das últimas sínteses é elucidada em um entrevista com os dois cientistas, Christine Beemelmanns e Hans-Ulrich Reissig de Berlim, Alemanha, que estiveram diretamente envolvidos.
Tabela 2. Sínteses totais formais da estricnina publicadas até 2010.
| No. | Autor | Ano | Enantiômero | Etapas | Rendimento | Anéis Sintetizados |
| 1 | Woodward | 1954 | (–) | 29 | <0.1 | A→B→C→G→E→D→F |
| 2 | Magnus | 1992 | (–) | 30 | <0.1 | AB→D→CE→F→G |
| 3 | Overman | 1993 1995 | (–) (+) | 27 24 | 3.0 | A→D→CE→B→F→G |
| 4 | Kuehne | 1993 | (rac) | 20 | 1.0 | AB→CE→D→G→F |
| 5 | Stork | 1992 | (rac) | 19 | n.d. | AB→CE→D→F→G |
| 6 | Rawal | 1994 | (rac) | 22 | 1.0 | A→C→E→G→D→F |
| 7 | Kuehne | 1998 | (–) | 22 | 3.5 | AB→CE→D→F→G |
| 8 | Bonjoch | 1999 | (–) | 22 | 0.2 | AE→C→D→B→F→G |
| 9 | Martin | 1999 | (rac) | 17 | 1.0 | AB→D→CE→F→G |
| 10 | Vollhardt | 2000 | (rac) | 19 | 0.1 | AB→EG→C→D→F |
| 11 | Bodwell* | 2002 | (rac) | 17 | 2.5 | AB→CEG→D→F |
| 12 | Shibasaki | 2002 | (–) | 30 | 1.0 | E→A→BD→C→F→G |
| 13 | Mori | 2002 | (–) | 27 | 0.1 | E→A→B→C→G→D→F |
| 14 | Fukuyama | 2004 | (–) | 29 | 1.0 | A→B→D→CE→F→G |
| 15 | Padwa | 2007 | (rac) | 22 | 0.5 | AB→CE→D→F→G |
| 16 | Andrade | 2010 | (rac) | 18 | 1.5 | AB→CE→D→F→G |
| 17 | Beemelmanns & Reissig | 2010 | (rac) | 16 | 1.0 | AB→EG→C→D→F |
* acabou por estar incorreto, veja abaixo
Tabela 3. Sínteses recentes totais formais da estricnina [50,52-53].
| No. | Autor | Ano |
| 18 | Vanderwal | 2011 |
| 19 | MacMillan | 2011 |
| 20 | Canesi | 2015 |
5. Síntese total da estricnina de Beemelmanns & Reissig, 2010
Esta síntese começa com dois compostos de laboratório disponíveis comercialmente: indol-3-acetonitrila (10, € 160/25 g) e ácido oxopimélico dietilester (11, € 120/25 g). Primeiro, o diéster 11 é convertido no monoéster, que também está disponível, mas é mais caro. A reação deste último com 10 dá o derivado de indol 12 (Fig. 10). Isso é seguido pelo que é realmente a etapa chave na síntese: uma ciclização dupla para o composto tetracíclico 13.
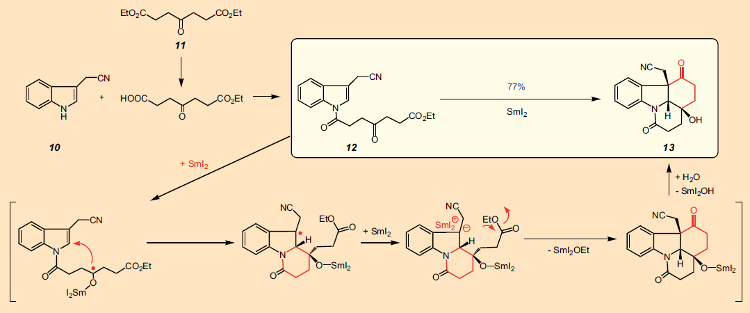
Aqui vemos, de uma só vez, a criação de dois anéis de seis membros com três estereocentros adjacentes, todos na configuração necessária para conversão em estricnina. A base para esta complexa série de reações é o poderoso agente redutor diiodeto de samário (SmI2, o reagente de Kagan). O potencial preparativo deste reagente tem sido explorado há muito tempo no grupo de pesquisa de Reissig em Berlim, Alemanha, e sua gama de aplicação ampliada. Nesse caso, uma molécula de diiodeto de samário ataca o grupo carbonila, transferindo um elétron, para produzir um radical cetila [48]. Este centro radical, por sua vez, ataca a posição 2 do indol, criando o primeiro anel de seis membros.
Uma segunda molécula de diiodeto de samário transfere então outro elétron para a posição 3 do indol, transformando um radical em um carbânion, que por sua vez realiza um ataque nucleofílico intramolecular ao átomo de carbono carbonil do grupo éster, fechando um segundo anel. Como consequência dos dois fechamentos sequenciais do anel, isso pode ser caracterizado como uma reação em cascata, que apesar do curso mecanicamente complexo dos eventos resulta em um rendimento de 77% do produto tetracíclico 13.Este sistema tetracíclico (13) com sua cadeia lateral -CH2-CN na posição 3 da unidade de indol, já inclui todos os átomos necessários para completar o próximo anel. O fechamento do terceiro anel subsequente ocorreu sem problemas, de modo que a partir do indol 10, três etapas alcançaram o sistema pentacíclico 14/15, para o qual Bodwell precisou de 13 etapas (ver Plano A na Fig. 11). Bodwell já havia descrito a transformação de 14/15 no precursor da estricnina 16 (cuja preparação em 18 etapas também havia sido relatada por Rawal [49]), então parecia que uma 17a síntese total formal de estricnina havia sido realizada com sucesso.
6. Foi um “Final Feliz”?
Com uma síntese total “formal”, não foi realizada uma síntese completa de um novo produto natural, apenas um até um precursor, que em uma data anterior já havia sido transformado na verdadeira molécula alvo.
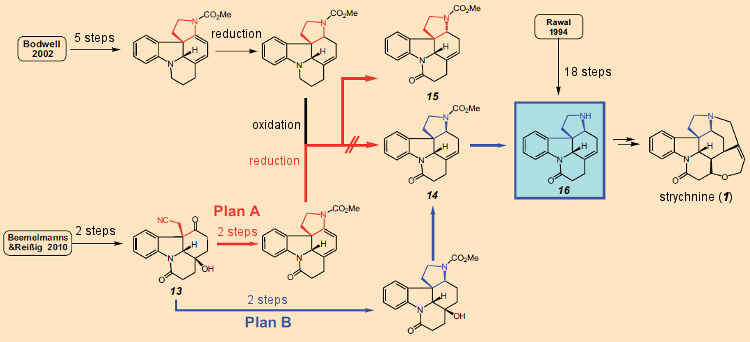
Um conjunto tedioso de análises de NMR mostrou, no entanto, que o produto não era de fato o composto desejado 14, com seu anel de cinco membros conectado -cis (azul), mas sim o estereoisômero 15, com uma relação trans(vermelho). A síntese total pretendida falhou, assim como a de Bodwell. Um novo “Plano B” foi, portanto, rapidamente desenvolvido, permitindo que o composto 13 fosse realmente transformado no desejado sistema pentacíclico 14 no curso de apenas três etapas. Dada a experiência anterior infeliz, e por razões de segurança, 14 conforme obtido, foi no entanto, convertido em 16, que se mostrou idêntico ao intermediário de Rawal.
A atribuição estrutural do sistema tetracíclico publicada por Bodwell revelou-se incorreta e Reissig descobriu que o tetraciclo preparado não era um precursor sintético de 16, mas de 15, que não pode ser transformado em estricnina. Portanto, essa síntese foi de fato um fracasso, e a síntese de estricnina de Bodwell não era mais sustentável!
Isso marcou o início de um drama, do qual os próprios pesquisadores falaram de forma bastante direta em sua entrevista. Acontece que as sínteses totais podem consistir em mais do que apenas esquemas de reação com suas muitas setas, retas e curvas, juntamente com muito trabalho árduo em laboratório. Os arredores, as circunstâncias e, claro, as emoções – que vão do triunfo à frustração – também desempenham um papel importante, assim como, é claro, a sorte de quem a merece.
Neste caso particular, os participantes tiveram muita sorte. Graças a um plano B desenvolvido rapidamente, eles foram capazes de circunavegar os obstáculos repentinamente encontrados, sem nem mesmo aumentar o comprimento da síntese. No início de maio de 2010, eles tiveram sucesso e foram capazes de encerrar sua síntese total de estricnina: o manuscrito correspondente foi rapidamente preparado e aceito e, em outubro de 2010, foi publicado. Tirem o chapéu!
Após a conclusão deste artigo, a síntese total de estricnina nº 18 foi publicada em fevereiro de 2011, distinguindo-se por menos etapas de reação e um fechamento de anel duplo muito original, embora o último tenha sido infelizmente limitado a um rendimento de apenas 5-10% [50]. Em 2015, Beemelmanns e Reissig desenvolveram outra rota curta para a estricnina usando uma ciclização em cascata induzida por samário-diiodeto como uma etapa chave. [51].
Agradecimentos
Sou especialmente grato ao Dr. C. Beemelmanns e ao Professor Hans-Ullrich Reissig, da Universidade Livre de Berlim, Alemanha, por seu apoio técnico em minha incursão neste campo desafiador e por sua disposição para falar abertamente sobre suas pesquisas.
Desejo ainda agradecer ao Dr. C. Czekelius, também da Universidade Livre de Berlim, por desconfiança com meu pedido de uma pitada de estricnina; Professor David W. Thomson, College of William and Mary, Williamsburg, Virginia, EUA, pelos materiais de ensino emprestados; Sabine Rinberger, Diretora do Valentin-Museum, Munique, Alemanha, por sua ajuda na pesquisa sobre Karl Valentin; Professor E. Vaupel, Deutsches Museum, Munique, Alemanha, pela ajuda na pesquisa básica; Professor Helmut Vorbrüggen, Universidade Livre de Berlim, por relatos de suas lembranças pessoais de RB Woodward; e Dr. S. Streller e Dr. P. Winchester, Universidade Livre de Berlim, pela valiosa ajuda com o manuscrito.
Referências
[45] J. Bonjoch, D. Solé, Chem. Rev. 2000, 100, 3455. DOI: 10.1021/cr9902547
[46] M. Mori, Heterocycles 2010, 81, 259. DOI: 10.3987/rev-09-661
[47] C. Beemelmanns, Ph.D. Thesis 2010, Freie Universität Berlin, Germany.
[48] C. Beemelmanns, H.-U. Reissig, Pure Appl. Chem. 2011, 83, 507. DOI: 10.1351/pac-con-10-09-06
[49] G. J. Bodwell, J. Li, Angew. Chem. Int. Ed. 2002, 17, 3261.
DOI: 10.1002/1521-3773(20020902)41:17<3261::AID-ANIE3261>3.0.CO;2-K
[50] D. B. C. Martin, C. D. Vanderwal, Chem Sci. 2011, 2, 649. DOI: 10.1039/c1sc00009h
[51] C. Beemelmanns, H.-U. Reissig, Chem. Eur. J. 2015, 21, 8416. DOI: 10.1002/chem.201500094
[52] D. W. C. MacMillan et al., Nature 2011, 475, 183–188. DOI: 10.1038/nature10232
[53] S. Canesi et al., Chem. Eur. J. 2015, 21, 7713–7715. DOI: 10.1002/chem.201500185
Texto traduzido por Prof. Dr. Luís Roberto Brudna Holzle ( luisbrudna@gmail.com). A tradução do original ‘Strychnine: From Isolation to Total Synthesis – Part 3’ foi gentilmente autorizada pelos detentores dos direitos.
PARTE 1 – Estricnina: Do Isolamento à Síntese Total
PARTE 2 – Estricnina: Do Isolamento à Síntese Total
PARTE 3 – Estricnina: Do Isolamento à Síntese Total



