Quando uma mistura de dois líquidos A e B observam um comportamento ideal, podemos dizer que obedecerão a Lei de Raoult. E por esta lei podemos verificar que a pressão parcial de vapor de cada componente é proporcional à sua fração molar no líquido. Ou seja
PA=PoA.xA
e
PB=PoB.xB
nas quais, PoB significa a pressão de vapor de B quando puro (normalmente em 25 oC), e PoA a pressão de vapor de A quando puro.
E então a pressão total de vapor será a soma destas duas pressões parciais.
P = PA + PA = PoB + (PoA – PoB).xA
; lembrando que xA + xB = 1
Misturas binárias que apresentam este comportamento ideal não são muito comuns, e para isto ocorrer as duas substâncias devem ser semelhantes, tais como apresentar uma estrutura molecular muito semelhante uma da outra, diferindo pouco em comportamento físico-químico. Como por exemplo em misturas, benzeno e tolueno; clorobenzeno e bromobenzeno; hexano e heptano; etc.
Soluções que apresentam um desvio desta idealidade, podem ter um desvio positivo ou negativo em relação à Lei de Raoult. Em um desvio positivo, a pressão parcial de A e B são maiores do que o esperado em um sistema ideal. Disto percebe-se que a interação entre as moléculas de A (A – A) e de B (B – B) são maiores do que as interações A com B (A – B). E mutatis mutandis para um desvio negativo da Lei de Raoult.
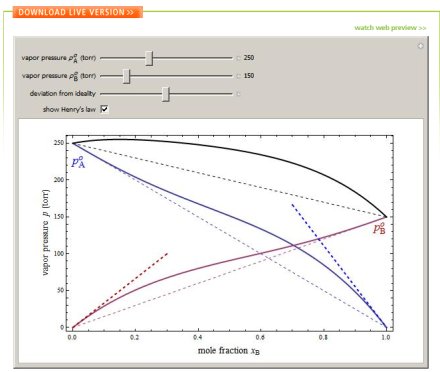
Na demonstração presente no Wolfram Demonstration Project vemos uma representação com aproximações qualitativas destes comportamentos. Ou seja, não existe um rigor matemático absoluto, e servem ilustração didática para entendermos este comportamento.
Nesta demonstração a curva em azul representa a pressão parcial de A, e a curva em vermelho a pressão parcial de B. A curva em preto mostra a pressão total deste sistema. Já as representadas em tracejadas demonstram os comportamentos idealizados.
Mesmo em sistemas não-ideais vemos que o comportamento da pressão parcial da A fica próximo ao da Lei de Raoult quando xA ~ 1. E vice-versa para o B.
E também para um sistema diluído, temos que este aproxima-se da Lei de Henry, cujas equações terão as relações lineares de, PA~KA.xA para xA ~0 , e PB~KB.xB para xB ~0.
Nestas o KB, e KA são chamados de constantes da Lei de Henry e dependem tanto da natureza do soluto quanto da do solvente.
E tais dados podem ser visualizados selecionando a opção ´show Henry´s law´.
Acesse a demonstração pelo link
https://demonstrations.wolfram.com/VaporPressuresOfBinarySolutions/