A criação de um homúnculo, um humano em miniatura artificial, de uma edição de 1899 do Fausto de Goethe.
O escritor de ciência Philip Ball mergulha no mito, na história e na ciência para desvendar as raízes de nossos medos da vida artificial.
Fazer a vida artificial não era uma dificuldade tão grande na antiguidade quanto é para nós. Qualquer um deveria ser capaz de fazer isso com a receita certa, assim como assar pão. O poeta romano Virgil descreveu um método para fazer abelhas sintéticas, uma prática conhecida como bougonia, que envolvia espancar um pobre bezerro até a morte, tapar o nariz e a boca e deixar a carcaça sobre uma cama de tomilho e paus de canela. “Criaturas criadas maravilhosamente aparecem”, escreveu ele, “primeiro sem membros, mas logo com asas”.
Isso era, é claro, simplesmente uma expressão da crença geral na geração espontânea: a ideia de que os seres vivos poderiam surgir do nada dentro de uma matriz fértil de matéria em decomposição. Cerca de 300 anos antes, Aristóteles, em seu livro Sobre a geração de animais, explicou como esse processo produziu vermes, insetos e camundongos. Ninguém duvidava que fosse possível, e ninguém temia também (além da inconveniência); ninguém estava “brincando de Deus”, fazendo uma nova vida dessa maneira.
O furor que algumas vezes acompanhou a nova ciência da biologia sintética – a tentativa de reestruturar os organismos vivos como se fossem máquinas para nós, ou para construí-los a partir do zero a partir das partes componentes – deriva de um constructo decididamente moderno, um “Reverência pela vida.” No passado, os receios sobre esse tipo de arrogância tecnológica eram reservados principalmente para propostas de criação de seres humanos por meios artificiais – ou, como diriam os gregos, pela téchne.
E se a ideia de fabricar os seres humanos carregava um sopro do proibido na antiguidade, a razão tinha mais a ver com uma desconfiança geral da techné do que com a desaprovação da criação de pessoas. Havia uma sensação de que as máquinas – o que os gregos chamavam de mechanomai – eram artifícios dúbios que faziam as coisas funcionarem de maneira contrária à natureza. Na física de Aristóteles, objetos pesados eram naturalmente aptos a descer, enquanto as máquinas podiam forçá-los fazer o oposto. Platão, professor de Aristóteles, desconfiava de toda arte (seja a pintura ou invenção) como uma imitação enganosa da natureza.
Como esses antigos preconceitos contra a techne ainda persistiam no século XVII, o filósofo inglês Francis Bacon achou necessário oferecer uma firme defesa do artificial. Ele não foi totalmente bem sucedido, a mesma desconfiança do “artificial” e “sintético” persiste ainda hoje. Parte da antipatia que a biologia sintética enfrentou decorre desse viés de longa data. Mas outra fonte arraigada da desconfiança vem da teologia cristã do final da era medieval, na qual a téchne arrogante que adulterou a vida humana arriscou invocar a ira de Deus. Na versão moderna e secular, a sacralidade da vida humana expandiu-se para abranger toda a natureza – e nós arriscamos a condenação da natureza, atrevendo-nos a intervir nos seres vivos. Esse é o tipo de transgressão agora implicado por uma das objeções comuns às pretensões da biologia sintética: seria “antinatural”.
A barganha faustiana
Quando os teólogos desaprovavam as alegações dos alquimistas de que podiam fazer um ser artificial conhecido como homúnculo, seu raciocínio não era necessariamente o que imaginamos. A acusação não era realmente de brincar de Deus, mas sim de forçar a mão de Deus. Pois embora possamos ser capazes de animar a matéria deste modo misterioso, somente Deus poderia dar-lhe uma alma. Deus teria então que intervir para alimentar o homúnculo? E será que, não tendo nascido da linhagem de Adão, estaria livre do pecado original e, portanto, não teria necessidade da salvação de Cristo?
Essas eram as questões que preocupavam os clérigos. Talvez também tenham incomodado o homúnculo: o criado pelo assistente de Fausto, Wagner, no relato de Goethe daquela velha história, anseia por ser totalmente humano, já que só então ele pode escapar do recipiente de vidro em que foi feito. “Eu mesmo desejo nascer”, diz ele.
Luigi e Giovanni Aldini – Galvanizando Corpos de Criminosos
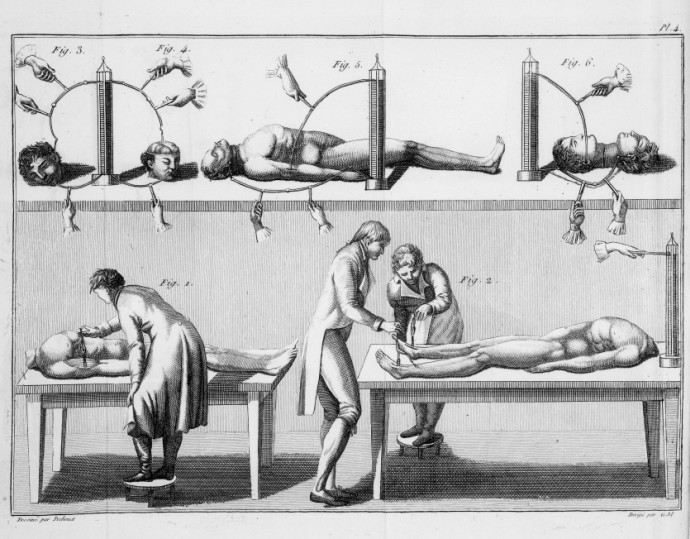
Ao escrever Frankenstein , Mary Shelley recorreu à ciência de seu tempo, incluindo a experimentação elétrica de Luigi Galvani e seu sobrinho Giovanni Aldini, cujos temas de teste incluíam os cadáveres de criminosos executados, como mostrado nesta ilustração de 1804. (Fonte:Biblioteca Wellcome, Londres)
A lenda de Fausto, que remete ao mágico bíblico Simon Magus, que lutou com magia contra São Pedro, fornece a pedra de toque para os medos dos cientistas ultrapassarem a marca e, sem querer, liberarem forças destrutivas. Fausto era, naturalmente, o modelo do mais famoso conto cautelar da ciência que se intrometia na criação da vida: o Frankenstein de Mary Shelley. O romance, publicado pela primeira vez anonimamente em 1818 com um prefácio de Percy Shelley (marido de Mary, que alguns suspeitavam ser o autor), reinventa o mito de Fausto para a era da ciência, com base na biologia do avô de Charles Darwin, Erasmus, a química de Humphry Davy e a fisiologia elétrica do italiano Luigi Galvani. Percy Shelley escreveu que as especulações de Erasmus Darwin, expostas em obras como Zoonomia, ou as Leis da Vida Orgânica (1794), apoiaram a ideia de que a reanimação de matéria morta de Victor Frankenstein “não era de ocorrência impossível”. E o palestrante de popularização da ciência Adam Walker, amigo do químico Joseph Priestley, escreveu que os experimentos de Galvani sobre fisiologia elétrica demonstraram a “relação ou afinidade [da eletricidade] com o princípio vivo”. Fazer vida estava no ar no início do século 19, e Frankenstein parece, em retrospecto, quase inevitável.
O médico de Mary Shelley e sua criação monstruosa são agora invocados como uma reação automática a todas as novas intervenções científicas na vida. Eles apareceram com destaque na cobertura da mídia sobre fertilização in vitro (FIV) e clonagem (“O mito de Frankenstein se torna realidade”, escreveu o New York Times sobre a fertilização in vitro), modificação genética de plantas (“Frankenfoods”) e agora a criação de formas de vida ”por biologia sintética (“ Frankenbugs ”). A mensagem é clara: a tecnologia assim rotulada é algo antinatural e perigoso, e garante nossa firme desaprovação.
Lodo primordial
A pré-história da biologia sintética não é toda faustiana. A aparente inclinação da vida para brotar da matéria sem vida estimulou a noção de um princípio animador que estava difundido no mundo, pronto para acelerar as substâncias quando as circunstâncias eram clementes. Nessa visão, uma propriedade que ficou conhecida como a “força vital” inerente aos próprios constituintes – os corpúsculos, ou moléculas – da matéria e da vida apareceu gradualmente quando um número suficiente dela se acumulou. Em sua estranha história D’Alembert’s Dream (1769), o filósofo francês Denis Diderot compara o movimento coerente de massas como “pontos de vida”, semelhantes a moléculas, a um enxame de abelhas, do tipo que Virgil acreditava que poderia ser evocado de uma vaca morta. Como o contemporâneo de Diderot, o naturalista francês George-Louis Leclerc, o conde de Buffon,
A vida do todo (animal ou vegetal) parece ser apenas o resultado de todas as ações, todas as pequenas vidas separadas. . . de cada uma dessas moléculas ativas cuja vida é primitiva e aparentemente indestrutível.
O vitalismo tem sido frequentemente ridicularizado pelos cientistas hoje como uma espécie de superstição pré-científica, mas na verdade esse tipo de hipótese provisória é precisamente o que é necessário para que a ciência progrida em um problema difícil. Ao supor que a vida era imanente na matéria, os primeiros cientistas conseguiram naturalizá-la e distingui-la de uma agente misteriosa, dado por Deus, e assim torná-la um objeto apropriado para estudo científico.
Os primeiros químicos acreditavam que o segredo da vida deveria residir na composição química: animar a matéria era apenas uma questão de obter a mistura certa de ingredientes.
Dito isto, não deveríamos nos surpreender que a síntese de ureia de Friedrich Wöhler (uma molécula que até agora apenas criaturas vivas poderiam produzir) em 1828 a partir de um sal de amônio não representasse uma ameaça profunda ao vitalismo, apesar de ser frequentemente citada como o começo do fim para a teoria. O potencial vital das moléculas era tudo uma questão de grau; então não havia motivo real para surpresa de que uma molécula associada a seres vivos pudesse ser feita a partir de matéria aparentemente inanimada. Na verdade, a crescente apreciação durante o século 19 de que “química orgânica” – a ciência das moléculas baseadas principalmente em carbono produzidas por e constituindo seres vivos – era contígua ao resto da química, apenas aprofundou o enigma do que é a vida, enquanto ao mesmo tempo, reforçava a visão de que a vida era uma questão para os cientistas e não para os teólogos.
Os primeiros químicos acreditavam que o segredo da vida deveria residir na composição química: animar a matéria era apenas uma questão de obter a mistura certa de ingredientes. Em 1835, o anatomista francês Félix Dujardin afirmou ter feito a substância viva primordial esmagando animais microscópicos em uma polpa gelatinosa. Quatro anos mais tarde, o fisiologista tcheco Jan Purkinje deu um nome a essa substância primitiva: o protoplasma, que se acreditava ser algum tipo de proteína e que estava imbuído da capacidade de se mover por conta própria.
Na década de 1860, o antigo defensor de Charles Darwin, Thomas Henry Huxley, afirmou ter encontrado essa substância primitiva, que ele alegava ser a “base física da vida”, ou “um tipo de matéria que é comum a todos os seres vivos”. Ele identificou essa substância com uma espécie de limo em que os organismos residentes no fundo do mar pareciam estar incorporados. O limo continha apenas os elementos carbono, hidrogênio, oxigênio e nitrogênio, disse Huxley. (Na verdade, seu protoplasma acabou sendo o produto de uma reação química entre a água do mar e o álcool usado para preservar os espécimes marinhos de Huxley.) Enquanto isso, o principal defensor alemão do darwinismo, Ernst Haeckel, declarou que existe uma espécie de força vital em toda a matéria, até o nível de átomos e moléculas; a descoberta da organização molecular em cristais líquidos na década de 1880 pareceu-lhe justificar a hipótese.
Haeckel estava, pelo menos, certo em se concentrar na organização. Desde que o fisiologista alemão Theodor Schwann propôs, em meados do século XIX, que toda a vida é composta de células, o conceito de protoplasma era confrontado com a necessidade de explicar a estrutura ordenada da vida: a gelatina não era suficiente. A geração espontânea foi finalmente eliminada pelos experimentos de Louis Pasteur e outros, mostrando que as misturas estéreis permaneciam assim, se fossem seladas para impedir o acesso aos microrganismos que Pasteur identificara sob o microscópio. Mas o vitalismo não morreu no processo, em vez disso transformou-se na noção de “organização orgânica” – a misteriosa propensão dos seres vivos a adquirir estrutura e coordenação entre seus componentes moleculares, que os biólogos começaram a discernir quando inspecionaram células sob o microscópio. Em outras palavras, a organização da vida aparente na escala visível se estendia não apenas ao nível celular, mas além dela. A noção de um protoplasma universal, entretanto, tornou-se insustentável quando a diversidade de componentes moleculares da vida, em particular a gama de enzimas proteicas, se tornou aparente através da análise química no início do século XX.
A gelatina primitiva tinha uma notável canção de cisne. Em 1899, o Boston Herald publicou a manchete “Criação da Vida… Animais Inferiores Produzidos por Meios Químicos ”. Deixando de lado o corolário possivelmente irônico apresentado na manchete “Imaculada Conceição Explicada”, o jornal descreveu a pesquisa do fisiologista alemão Jacques Loeb, que estava trabalhando no centro de biologia marinha em Woods Hole, Massachusetts. Loeb, de fato, não fizera nada tão notável; ele havia mostrado que um ovo de ouriço-do-mar não fertilizado podia ser induzido a sofrer partenogênese, dividindo-se e desenvolvendo-se pela exposição a certos sais. A visão mais ampla de Loeb, no entanto, preparou o palco para uma entrevista em 1902 que o relata dizendo:
Eu queria pegar a vida em minhas mãos e brincar com ela. Eu queria lidar com isso em meu laboratório como faria com qualquer outra reação química – para iniciá-la, pará-la, modificá-la, estudá-la sob todas as condições, para direcioná-la à minha vontade!
As palavras de Loeb soam quase como o sonho enlouquecido de um cientista louco de Hollywood. A Scientific American chegou a apelidar Loeb de “o Frankenstein Científico”. Não é preciso dizer que Loeb nunca foi capaz de fazer nada do tipo; mas seu desejo de controlar a vida através de uma perspectiva de engenharia se mostrou presciente, e foi mais proeminentemente apresentado em seu livro The Mechanistic Conception of Life (1912).
Geração espontânea

Um exemplo de geração espontânea, como ilustrado no relato de 1605 de plantas míticas, do jurista e naturalista francês Claude Duret, Histoire admirable des plantes et herbes esmerveillables et miraculeuses en nature. (Fonte: Biblioteca Wellcome, Londres)
No circuito
O sonho de Loeb de “brincar” com a vida não poderia ser realizado até que tivéssemos uma melhor concepção dos componentes da vida. Encontrar esses componentes foi a missão da biologia molecular do século 20, que emergiu em grande parte dos estudos da estrutura química e composição de proteínas usando a cristalografia de raios X, iniciada de 1930 a 1950 por J. Desmond Bernal, William Astbury, Dorothy Hodgkin, Linus Pauling e outros. Essas moléculas pareciam máquinas minúsculas, projetadas e moldadas pela evolução para fazer seu trabalho.
Mas é claro que a biologia molecular não era apenas sobre proteínas. O que realmente mudou o jogo foi a descoberta do que parecia ser a fonte da organização milagrosa da vida. Não era, como muitos previram, uma proteína que transportava as informações necessárias para regular a célula, mas sim um ácido nucléico: o DNA. Quando James Watson e Francis Crick usaram os dados cristalográficos de raios X de outros, incluindo o de Rosalind Franklin, para deduzir a forma helicoidal dupla da molécula em 1953, nem todos os cientistas acreditavam que o DNA fosse o veículo dos genes que aparentavam passar instruções de uma geração para a próxima. O trabalho de Watson e Crick mostrou como essa informação foi codificada – em uma sequência digital de blocos moleculares ao longo da hélice – e, além disso, implicou um mecanismo pelo qual a informação poderia ser copiada durante a replicação.
Se essas fossem de fato “instruções para a vida”, então a química poderia ser usada para modificá-las. Esse foi o negócio da engenharia genética, que decolou na década de 1970, quando os cientistas descobriram como usar enzimas naturais para editar e colar partes do DNA “recombinante”. Os biólogos moleculares estavam agora pensando na vida como uma forma de engenharia, passível de design.
A biologia sintética às vezes tem sido chamada de “engenharia genética que funciona”: usando os mesmos métodos biotecnológicos de recortar e colar, mas com uma sofisticação que obtém resultados. Essa definição é talvez um pouco injusta porque a engenharia genética “antiquada” funcionou perfeitamente para alguns propósitos: ao inserir um gene para fazer insulina em bactérias, por exemplo, esse composto, vital para o tratamento da diabetes, pode ser feito por fermentação de microorganismos, em vez de extrair de vacas e porcos. Mas intervenções mais profundas nos processos químicos dos organismos vivos podem exigir muito mais do que a adição de um gene ou dois. Tais intervenções são o que a biologia sintética pretende alcançar.
Tomemos a produção da droga antimalárica artemisinina, cuja descoberta foi o tema do Prêmio Nobel 2015 em medicina. Esta molécula oferece a melhor proteção atualmente disponível contra a malária, funcionando efetivamente quando o parasita da malária desenvolveu resistência à maioria dos outros antimaláricos comuns. A artemisinina é extraída de um arbusto cultivado para esse fim, mas o processo é lento e caro. (Os preços caíram recentemente.) Ao longo da última década, pesquisadores da Universidade da Califórnia, em Berkeley, tentaram manipular a maquinaria de fabricação de artemisinina da planta em células de levedura, de modo que a droga pudesse ser produzida a baixo preço pela fermentação. É complicado porque a molécula é produzida em um processo de várias etapas envolvendo várias enzimas que têm que transformar o ingrediente bruto, etapa por etapa, na molécula final complexa, com cada etapa sendo conduzida no momento certo. Com efeito, isso significa equipar a levedura com os genes e os processos de regulação necessários para uma nova via metabólica, ou sequência de reações bioquímicas – uma abordagem chamada engenharia metabólica, equivalente ao tipo de reaproveitamento planejado de um organismo que é um objetivo central da biologia sintética.
A síntese de artemisinina em levedura (mais propriamente, semissíntese desde que começa com um precursor da molécula de droga colhida de fontes naturais) é frequentemente chamada de garoto propaganda da biologia sintética – não apenas porque funciona (o processo agora está entrando na produção comercial), mas porque tem objetivos inequivocamente benevolentes e valiosos. Criar produtos úteis, dizem os defensores, é tudo o que eles estão tentando fazer: não criar monstruosidades não-naturais no estilo Frankenstein, mas a produção eficiente de drogas e outras substâncias necessárias, idealmente usando caminhos bioquímicos em organismos vivos como uma alternativa aos possíveis processos tóxicos, carregados de solvente, da química industrial.
Imagine bactérias e leveduras projetadas para produzir combustíveis “verdes”, como hidrogênio ou etanol, alimentados por matéria vegetal e eliminando a necessidade de minerar e queimar carvão e petróleo. Imagine plásticos facilmente biodegradáveis produzidos desta maneira, e não a partir de petróleo. Craig Venter, que fez seu nome (e dinheiro) desenvolvendo tecnologias de decodificação do genoma, fez de tais objetivos um elemento central da pesquisa realizada em seu J. Craig Venter Institute (JCVI) em Rockville, Maryland. Em abril passado, cientistas da JCVI anunciaram que inventaram maneiras de projetar microalgas chamadas diatomáceas, usando os métodos da biologia sintética, para que elas juntem bactérias e leveduras como veículos para a fabricação de biocombustíveis e outros produtos químicos.
Na verdade, a JCVI está tentando criar fábricas vivas microscópicas. O mesmo motivo sustentou a criação de Venter de um suposto “organismo sintético” em 2010, outro dos marcos da biologia sintética – o Frankenbug, nas palavras de alguns oponentes da manipulação genética. Se esses micróbios podem ser considerados verdadeiramente artificiais é uma questão de debate. Os cientistas do JCVI usaram métodos químicos bem estabelecidos para construir um genoma inteiro a partir do DNA, baseado no de uma bactéria natural chamada Mycoplasma mycoides, mas com algumas sequências genéticas adicionadas e outras omitidas. Eles então pegaram células de uma bactéria Mycoplasma intimamente relacionada, extraíram seu DNA original, inseriram as substituições artificiais e “carregaram” as células modificadas como se fossem computadores com um novo sistema operacional. As células funcionaram bem com seu novo DNA sob medida.
O objetivo não era uma demonstração arrogante de controle sobre a vida, mas uma verificação de que as células bacterianas podem ser equipadas com novas instruções que podem ser uma versão simplificada de suas naturais: um tipo de chassi mínimo no qual novas funções podem ser projetadas e construídas. O funcionamento genético completo das bactérias mais simples não é completamente compreendido, mas se os genomas deles puderem ser simplificados para remover todas as funções que não são essenciais para sustentar a vida, a tarefa de projetar novos caminhos e processos genéticos se torna muito mais fácil. Em março deste ano, a equipe do JCVI descreveu uma versão “mínima” da bactéria Mycoplasma .
A linguagem dessa nova ciência é a do engenheiro e designer: a linguagem do artesão, não do filósofo natural que descobre como a natureza funciona. Essa maneira de pensar a vida remonta, pelo menos, a René Descartes, que concebeu o corpo como uma máquina, um mecanismo de alavancas, polias e bombas. No tempo de Descartes, essa visão mecânica da vida não levaria a nada mais do que simulacros mecânicos grosseiros: os autômatos feitos por relojoeiros e inventores, engenhocas engenhosas e misteriosas em si, mas que no final não são mais animadas que os ponteiros de um relógio. Mas a biologia sintética traz a filosofia newtoniana, mecanicista, para as próprias coisas da vida, para os genes e enzimas das células vivas: eles são agora os dentes e engrenagens que podem ser encaixados, impulsionados por molas, lubrificados e montados em mecanismos moleculares. Então não temos uma mera simulação da vida, mas a própria vida.
A linguagem dessa nova ciência é a do engenheiro e designer: a linguagem do artesão, não do filósofo natural que descobre como a natureza funciona.
No entanto, a linguagem atual não é tanto a mecânica e a mecânica do relógio, mas o equivalente moderno: nossa mais recente tecnologia de ponta, ou seja, eletrônica e computação. Desde que os biólogos François Jacob, Jacques Monod e outros mostraram na década de 1960 como os genes são regulados para controlar sua atividade, a genética adotou o léxico da teoria dos sistemas cibernéticos, que foi desenvolvido para entender como controlar sistemas tecnológicos complexos e encontrar aplicações em eletrônica, engenharia, robótica, comunicações e computação. Ou seja, diz-se que diferentes componentes do genoma estão ligados em circuitos e regulados por loops e interruptores de feedback à medida que passam sinais de uma unidade para outra.

Der Mensch als Industriepalast (Homem como um Palácio industrial), um cartaz em tamanho natural encomendado pelo médico e escritor alemão Fritz Kahn em 1926, imagina o corpo humano como uma fábrica química em miniatura. (Fonte: Biblioteca Nacional de Medicina)
Nessa visão, os genomas desempenham seu papel de organizar e regular a vida de maneira modular e hierárquica, assim como os componentes eletrônicos são conectados a elementos básicos do circuito, como amplificadores ou dispositivos lógicos, que por sua vez são organizados de modo a permitir funções de nível superior, como armazenamento de memória e recuperação ou sincronização de sinais.
Essa noção de circuito genético é a plataforma conceitual sobre a qual a biologia sintética está sendo construída. No esquema BioBricks criado por pesquisadores do Instituto de Tecnologia de Massachusetts (MIT), os genes podem ser combinados e compilados em um Registro de Peças Biológicas Padrão: um catálogo de acesso aberto de circuitos genéticos biológicos que você pode ler como faria com um catálogo de componentes eletrônicos da RadioShack, procurando os dispositivos que você precisa para realizar seu projeto. O objetivo é que, com atenção suficiente à padronização, essas partes biológicas funcionem como “plug and play”, sem precisar de muito refinamento e ajuste para cada aplicação.
Este conceito plug-and-play funciona notavelmente bem. Os primeiros triunfos para a biologia sintética incluíram a demonstração de circuitos gênicos que agiam como osciladores (permitindo que a taxa de síntese de uma proteína fosse ativada e diminuída periodicamente) e comutadores (permitindo a ativação e desativação controláveis da síntese de proteínas usando um produto químico ou sinal luminoso). Dessa forma, os pesquisadores criaram bactérias que se acendiam periodicamente por meio de uma proteína fluorescente cuja produção estava ligada a um circuito oscilador genético. Desde 2004, a equipe do MIT promove um evento anual chamado de competição internacional de máquinas geneticamente modificadas, no qual as equipes de alunos competem para apresentar o mais inovador projeto de biologia sintética. As inscrições incluíram “E. chromi ”, E. coli geneticamente modificada que pode mudar para todas as cores do arco-íris em resposta a sinais específicos (como gases tóxicos ou contaminantes de alimentos), células de combustível microbianas que geram eletricidade pela E. coli modificada e fotografia bacteriana usando E. Coli modificada para produzir produtos químicos que tornam um filme preto em resposta à luz.
Vida como informação
A orientação de engenharia de sistemas da biologia sintética reflete a mais recente mudança em nossa visão da vida. Na era da alquimia, a vida era vista como uma espécie de espírito vital, uma força oculta que permeava a natureza. Newton e Descartes fizeram disso uma questão de mecânica; Galvani transformou-a em um fenômeno elétrico, enquanto o surgimento da química no século XIX fez com que se tratasse de composição química. Mas desde que a descoberta de Watson e Crick casou com a genética neodarwiniana da biologia molecular, a vida tem sido cada vez mais encarada como uma questão de informação e é frequentemente descrita como um código digital impresso na memória molecular que é a sequência genética do DNA. Redesenhar a vida, como a engenharia da computação, é uma questão de codificação e design de circuitos.
Analisados historicamente, parece provável que nossa visão atual da vida se torne tão obsoleta quanto as antigas. Mas talvez não devêssemos ver essa sucessão simplesmente como uma substituição de uma ideia por outra. Alguns aspectos de todos os modelos antigos ainda podem ser defendidos: uma metáfora de máquina funciona muito bem, pelo menos para as proteínas motoras que movem objetos ao redor da célula. E o conceito de organização celular agora faz mais sentido à luz das ideias contemporâneas sobre a auto- organização molecular. O mesmo certamente será verdade para o modelo de vida como uma forma de computação. No entanto, a insistência em uma equivalência simples entre o computador e a célula é claramente inadequada. A velha imagem dos genes como unidades fundamentais de informação traduzidas de maneira linear e única em proteínas que agem como cavalos de batalha moleculares da biologia é demasiado simples. Os genomas não são modelos de um organismo mais do que “livros da vida”. A vida tem uma lógica que ainda temos que discernir, e não parece mapear facilmente em nenhuma tecnologia atualmente conhecida. Por esta razão, permanecemos distantes de qualquer síntese genuinamente inovadora da vida.
Brincando de Deus?
Podemos nos surpreender que as primeiras tentativas de fazer “vida sintética” tenham despertado tão pouca controvérsia. Mas foram os insights da biologia moderna – da unidade da vida no nível molecular – que tornaram controverso o “fazer a vida”. Agora, intervir nos processos fundamentais de qualquer coisa viva traz implicações para nós também. Talvez menos obviamente, essas implicações dependem da secularização de nossa visão da vida. Somente quando os seres humanos não são mais seres privilegiados, favorecidos e animados por Deus, a engenharia de todas as coisas vivas parece problemática. A sacralidade da vida humana foi generalizada para uma deificação da natureza precisamente porque nossa era não é mais governada moralmente pela doutrina cristã. Portanto, não é de se surpreender que as acusações de “brincar de Deus” com a biotecnologia provenham menos dos círculos religiosos – não há base teológica para o conceito – do que das seculares.
No entanto, a religião é apenas uma forma de mito – e o mito mais amplo ainda importa. Escrevendo em 1924 sobre a criação “artificial” da vida humana tanto por fertilização in vitro como por hipotética gestação fora do útero, o biólogo J. B. S. Haldane declarou que
O inventor químico ou físico é sempre um Prometheus. Não há grande invenção, do fogo ao voo, que não foi saudado como um insulto a algum deus.
Ele estava certo, mas os cientistas tendem a esquecer o porquê. Eles lamentam a tendência de lançar avanços científicos em termos míticos para que a sombra de Fausto e Frankenstein caia sobre todos os desenvolvimentos na modificação e gênese da vida. Essa frustração é compreensível: a metáfora “Franken” é um jornalismo preguiçoso, um pedaço de sensacionalismo pronto para ser usado para produzir um frisson sedutor (junto com uma justa indignação) nos leitores. Mas uma das funções do mito é dar forma a medos e sonhos que mal podemos articular.
A vida tem uma lógica que ainda temos que discernir e não parece mapear facilmente em nenhuma tecnologia atualmente conhecida. Por esta razão, permanecemos distantes de qualquer síntese genuinamente inovadora da vida.
A biologia sintética parece ir ao coração de uma das mais profundas e antigas dessas imaginações: a criação e o controle da vida através da techné . Esse grande objetivo pode parecer muito longe de fazer uma bactéria que pisca. Mas a biologia sintética tem um potencial que vai muito além: esse campo pode não apenas ser transformador na fabricação de materiais, medicamentos e muito mais, mas poderia reformular nossa concepção do que são organismos vivos, o que eles podem ser e como podemos intervir para moldá-los. Não deveríamos achar surpreendente se tais poderes despertem velhos mitos e associações. Para navegar no debate cultural, precisamos estar cientes da influência histórica de nossos mitos, suas mensagens morais ocultas e os preconceitos e premonições que elas invocam. Nunca houve um Fausto que negociou com o diabo, o monstro de Frankenstein nunca foi criado, o Admirável Mundo Novo nunca chegou – mas a verdadeira razão pela qual ainda estamos invocando essas imagens é que elas ainda se encaixam nas formas de nossos pesadelos.
Texto escrito por Philip Ball.
Traduzido por Prof. Dr. Luís Roberto Brudna ( [email protected] ) do original ‘Man Made: A History of Synthetic Life‘ com autorização oficial dos detentores dos direitos. Revisado por: Natanna Antunes, Kelly Vargas e Larissa Gomes.
Original (English) content from Science History Institute (https://www.sciencehistory.org/). Content translated with permission, but portuguese text not reviewed by the original author. Please do not distribute beyond this site without permission. [[Conteúdo original (inglês) do Science History Institute (https://www.sciencehistory.org/) . Conteúdo traduzido com permissão, mas o texto em português não foi revisado pelo autor do original. Por favor, não distribua o conteúdo sem permissão.]]